Что нового в
Прогерия Исследования
Мы добавили этот раздел, чтобы вы могли легко получить доступ к информации о последних и наиболее значимых научных публикациях по исследованиям прогерии.
В дополнение к статьям, выделенным ниже, в настоящее время имеются сотни статей по темам, связанным с прогерией и прогерией. Мы предлагаем вам поискать в PubMed, чтобы найти конкретные темы, которые вы ищете.
Март 2023 г.: важные вехи исследований в области оценки лечения и продления жизни!
Мы рады поделиться с вами двумя захватывающими новостями исследований, опубликованными сегодня в ведущем мировом журнале по сердечно-сосудистым заболеваниям. Тираж (1):
Биомаркер в прогерии
Новый способ измерения прогерина, токсического белка, вызывающего прогерию, был разработан группой под руководством соучредителя PRF и медицинского директора доктора Лесли Гордон. С открытием этого биомаркера, который использует плазму крови для измерения уровня прогерина, исследователи могут понять, как лечение влияет на участников клинических испытаний через более короткий период времени и в нескольких точках на протяжении каждого клинического испытания.
Этот тест может оптимизировать процесс клинических испытаний путем предоставление ранней информации об эффективности тестируемых методов лечения, в качестве подготовки к другим клиническим тестам, таким как увеличение веса, дерматологические изменения, контрактура и функция суставов и т. Д., Все из которых требуют гораздо больше времени для проявления. Эти клинические особенности прогерии являются важными долгосрочными показателями эффектов лечения, которые теперь дополняются уровнями прогерина, измеренными ранее в терапии. Теперь мы можем понять преимущества лечения уже через четыре месяца после начала лечения или прекратить лечение, которое может не принести пользы участнику исследования, чтобы избежать ненужных побочных эффектов.
Еще более долгая жизнь с лонафарнибом
Этот новый и инновационный способ измерения прогерина не только ускоряет будущие открытия в области лечения и излечения, но и указывает на то, что долгосрочная польза лонафарниба для детей с прогерией больше, чем предполагалось ранее.
Данные исследования показывают, что более низкие уровни прогерина в крови отражают пользу для выживания: чем дольше кто-то с прогерией оставался на лонафарнибе, тем больше пользы для выживания от терапии. Уровни прогерина снижались примерно на 30-60% на протяжении всего времени приема препарата, а ожидаемая продолжительность жизни пациентов, получавших лечение более 10 лет, увеличивалась почти на 5 лет. Это увеличение средней продолжительности жизни более чем на 35%, с 14.5 лет до почти 20 лет!
Чтобы узнать больше, см. наш пресс-релиз здесь
«Одна из самых замечательных историй, когда-либо рассказанных в этом подкасте»
– Доктор Кэролайн Лэм, всемирно известный кардиолог и ведущая подкаста. Тираж в бегах, в путешествии, которое привело к этим захватывающим открытиям. Прослушать полное интервью о глубоком влиянии этого исследования непосредственно от доктора Гордона. Слушать здесь (начиная с 6:41).
Слушайте доктора Лесли Гордон в подкасте Circulation on the Run
А в июне две редакционные газеты (2) и (3) были опубликованы в Обращение подчеркивая критическую важность этого биомаркера для продвижения методов лечения и лечения детей с прогерией, а также для лучшего понимания старения.

(1) Гордон Л.Б., Норрис В., Хамрен С., и др.. Плазменный прогерин у пациентов с синдромом Хатчинсона-Гилфорда прогерия: разработка иммунологического анализа и клиническая оценка. Обращение, 2023
(2) Прогрессирование аномалий сердца при синдроме Хатчинсона-Гилфорда прогерия: проспективное лонгитюдное исследование.
Олсен Ф.Дж., Гордон Л.Б., Смут Л., Клейнман М.Е., Герхард-Херман М., Хегде С.М., Мукундан С., Махони Т., Массаро Дж., Ха С., Пракаш А. Обращение. 2023 6 июня; 147(23):1782-1784. doi: 10.1161/РАСПИСАНИЕ AHA.123.064370. Epub 2023 5 июня.
(3) Легкодоступные инструменты для обнаружения прогрессирования прогерина и сердечных заболеваний при синдроме Хатчинсона-Гилфорда прогерия.
Эрикссон М., Хаугаа К., Ревечон Г. Обращение. 2023 6 июня; 147(23):1745-1747. doi: 10.1161/РАСПИСАНИЕ AHA.123.064765. Epub 2023 5 июня.
Март 2021 г .: Захватывающие открытия в РНК-терапии прогерии!
Мы очень рады поделиться результатами два очень захватывающих прорывных исследования использования РНК-терапевтических средств в исследованиях Прогерии. Оба исследования были софинансированы Исследовательским фондом Прогерии (PRF), а соавтором - медицинским директором PRF, доктором Лесли Гордоном.
Прогерин - это белок, вызывающий болезни в прогерии. РНК-терапия влияет на способность организма вырабатывать прогерин, блокируя его производство на уровне РНК. Это означает, что лечение более специфичное, чем большинство методов лечения которые нацелены на прогерин на уровне белка.
Хотя в каждом исследовании использовалась разная система доставки лекарств, оба исследования были нацелены на одну и ту же базовую стратегию лечения, подавляя выработку РНК, кодирующей аномальный белок, прогерин. Оба были под руководством исследователей из Национального института здоровья (NIH) и были опубликованы сегодня в журнале. Nature Medicine.
Одно исследованиепод руководством Фрэнсиса Коллинза, доктора медицины, доктора философии, директора Национального института здоровья, показали, что лечение мышей прогерии препаратом под названием SRP2001 rвызывает вредную экспрессию мРНК прогерина и белка в аорте, основная артерия в теле, а также в других тканях. В конце исследования стенка аорты оставалась более прочной, и мыши демонстрировали увеличенная выживаемость более 60%.
«То, что таргетированная РНК-терапия показала такие значимые результаты на модели животных, я надеюсь, что это может привести к значительному прогрессу в лечении прогерии», - сказал Коллинз.
Ассоциация другое исследованиепод руководством Тома Мистели, доктора философии, директора Центра исследований рака Национального института рака, NIH, продемонстрировали 90-95% снижение токсичной РНК, продуцирующей прогерин в различных тканях после лечения препаратом LB143. Лаборатория Мистели обнаружила, что снижение протеина прогерина было наиболее эффективным в печени, с дополнительными улучшениями в сердце и аорте.
Теперь мы знаем, что есть несколько способов уменьшить выработку вредного белка прогерина с помощью РНК-терапии. Каждое исследование обнаружило различные участки РНК в моделях мышей, которые при нацеливании обеспечивали эффективный путь лечения, что приводило к Мыши Progeria, которые жили намного дольше, чем те, которые получали Zokinvy (лонафарниб) в предыдущих исследованиях., единственный одобренный FDA препарат для детей с прогерией. Кроме того, исследователи обнаружили, что комбинированное лечение с использованием РНК-терапевтических средств и зокинви (лонафарниб) снижает уровень белка прогерина в печени и сердце более эффективно, чем любое отдельное лечение.
«Эти два очень важных исследования демонстрируют основные достижения, которые сейчас на нас в области целенаправленной терапии прогерии », - сказал медицинский директор PRF д-р Лесли Гордон. «Я был счастлив работать с этими блестящими исследовательскими группами над продвижением РНК-терапии для детей с прогерией. Оба являются захватывающими исследованиями, подтверждающими принцип действия, и PRF рада продвигаться к клиническим испытаниям которые применяют эти стратегии лечения.
-
Erdos, MR, Cabral, WA, Tavarez, UL и другие Целенаправленный антисмысловой терапевтический подход к синдрому прогерии Хатчинсона – Гилфорда. Nat Med (2021). https://doi.org/10.1038/s41591-021-01274-0
Путтараджу, М., Джексон, М., Кляйн, С. и другие Систематический скрининг определяет терапевтические антисмысловые олигонуклеотиды для синдрома прогерии Хатчинсона – Гилфорда. Nat Med (2021). https://doi.org/10.1038/s41591-021-01262-4
Январь 2021: Значительный прогресс в генетическом редактировании моделей мышей прогерии.
Научный журнал природа опубликовал прорывные результаты продемонстрировав, что генетическое редактирование на мышиной модели прогерии исправило мутацию, вызывающую прогерию во многих клетках, улучшило несколько ключевых симптомов заболевания и резко увеличило продолжительность жизни у мышей.
Исследование, финансируемое PRF и в соавторстве с медицинским директором PRF доктором Лесли Гордоном, показало, что с помощью одной инъекции базового редактора, запрограммированного на исправление вызывающей заболевание мутации, мыши выжили в 2.5 раза дольше, чем контрольные необработанные мыши Progeria. возрасту, соответствующему началу старости у здоровых мышей. Важно отметить, что у обработанных мышей также сохранилась здоровая сосудистая ткань - важный результат, поскольку потеря целостности сосудов является предиктором смертности у детей с прогерией.
Исследование проводилось совместно с мировым экспертом по генетическому редактированию Дэвидом Лю, доктором философии Института Броуда, Массачусетский технологический институт, Джонатаном Брауном, доцентом кафедры сердечно-сосудистой медицины Университета Вандербильта, и Фрэнсисом Коллинзом, доктором медицины, доктором философии, Директор Национального института здоровья.
«Увидеть этот драматический отклик в нашей модели мышей прогерии - одно из самых захватывающих терапевтических достижений, в которых я участвовал за 40 лет как врач-ученый», - сказал д-р Коллинз.
«Пять лет назад мы все еще заканчивали разработку самого первого редактора базовых данных», - сказал доктор Лю. «Если бы вы сказали мне тогда, что в течение пяти лет однократная доза базового редактора может воздействовать на прогерию у животного на уровне ДНК, РНК, белка, сосудистой патологии и продолжительности жизни, я бы сказал:« Нет никакого способа ». Это настоящее свидетельство самоотверженности команды, благодаря которой эта работа стала возможной ».
Для изучения этих результатов необходимы дополнительные доклинические исследования, которые, как мы надеемся, однажды приведут к клиническим испытаниям. Узнайте больше об этой захватывающей новости в этом Wall Street Journal гайд.
Ноябрь 2020 г .: одобрение FDA для лонафарниба (Зокинви)
20 ноября 2020 года PRF выполнила важную часть нашей миссии: лонафарниб, первое в истории лекарство от прогерии, получил одобрение FDA.
В настоящее время прогерия объединяет менее 5% редких заболеваний с одобренным FDA лечением. * Дети и молодые люди с прогерией в США теперь могут получать лонафарниб (теперь называемый «Зокинви») по рецепту, а не в ходе клинических испытаний.
Эта важная веха наступила благодаря 13 непрерывным годам исследований, включающих четыре клинических испытания, все из которых координируются PRF, стали возможными благодаря отважным детям и их семьям и финансируются вами, замечательным сообществом доноров PRF.
Открыть чтобы получить больше информации.
* 300 редких заболеваний, лечение которых одобрено FDA (https://www.rarediseases.info.nih.gov/diseases/FDS-orphan-drugs) / 7,000 редких заболеваний, молекулярная основа которых известна (www.OMIM. орг) = 4.2%
Апрель 2018: глобальное исследование, опубликованное в JAMA, показало, что лечение лонафарнибом продлевает выживание у детей с прогерией
Кликните сюда Больше подробностей.
Ассоциация лечения лонафарнибом и отсутствием лечения с уровнем смертности у пациентов с синдромом Хатчинсона-Гилфорда Прогерия, Лесли Б. Гордон, доктор медицинских наук; Хизер Шаппелл, доктор философии; Джо Массаро, доктор философии; Ральф Б. Д'Агостино-старший, доктор философии; Джоан Брейзер, MS; Сьюзен Э. Кэмпбелл, Массачусетс; Моника Э. Клейнман, доктор медицины; Марк В. Киран, доктор медицинских наук; JAMA, Апрель 24, 2018.
Июль 2016: результаты тройного испытания
Октябрь 2014: замечательное путешествие PRF опубликовано в Expert Opinion
 В статье, опубликованной в Мнение эксперта Авторы - исполнительный директор Одри Гордон и медицинский директор Лесли Гордон. Два лидера PRF обсуждают историю, цели и достижения PRF, а также то, как программы PRF стали ключевыми в пути от безвестности к лечению.
В статье, опубликованной в Мнение эксперта Авторы - исполнительный директор Одри Гордон и медицинский директор Лесли Гордон. Два лидера PRF обсуждают историю, цели и достижения PRF, а также то, как программы PRF стали ключевыми в пути от безвестности к лечению.
Авторы пишут: «Мы надеемся, что приведенное ниже описание программ и услуг PRF, а также описание того, как они помогают PRF выполнить свою миссию по спасению детей с прогерией, поможет и вдохновит других предпринять аналогичные действия для множество редких заболеваний, которые требуют немедленного внимания ».
Май 2014: исследование показало, что пробные лекарства увеличивают предполагаемую продолжительность жизни у детей с прогерией
Это исследование демонстрирует, что есть доказательства того, что ингибитор фарнезилтрансферазы (FTI) может продлить жизнь детей с прогерией, по крайней мере, на полтора года. Исследование показало увеличение средней продолжительности жизни 1.6 в течение шести лет после начала лечения. Два дополнительных препарата, добавленных позже в испытаниях, правастатин и золедронат, также могут способствовать этому открытию. Это первое свидетельство лечения, влияющего на выживание для этого смертельного заболевания.
Открыть Больше подробностей.
Влияние ингибиторов фарнезилирования на выживаемость при синдроме Хатчинсона-Гилфорда, Прогерия, Лесли Б. Гордон, доктор медицинских наук, Джо Массаро, доктор философии, Ральф Б. Д'Агостино-старший, доктор философии, Сьюзен Э. Кэмпбелл, М. А., Джоан Брейзер, М. С., W. Ted Brown, MD, PhD, Monica E Kleinman, MD, Mark W. Kieran MD, PhD и совместные клинические испытания Progeria; Обращение, Май 2, 2014 (онлайн).
Сентябрь 2012: открыт первый в мире метод лечения прогерии для лечения прогерии
Результаты первое в истории клиническое испытание лекарств для детей с прогерией показывают, что лонафарниб, тип ингибитора фарнезилтрансферазы (FTI), первоначально разработанный для лечения рака, оказался эффективным для прогерии. Каждый ребенок демонстрирует улучшение одним или несколькими из четырех способов: прибавка в весе, улучшение слуха, улучшение структуры костей и / или, что наиболее важно, повышение гибкости кровеносных сосудов. Исследование * финансировалось и координировалось Исследовательским фондом Прогерии.
Открыть Больше подробностей.
* Гордон Л.Б., Клейнман М.Е., Миллер Д.Т., Нойберг Д., Джобби-Хердер А., Герхард-Герман М., Смут Л., Гордон С.М., Кливленд Р., Снайдер Б.Д., Флигор Б., Епископ В.Р., Статкевич П., Реген А, Сонис А, Райли С., Плоски С., Коррейа А., Куинн Н., Ульрих Н. Дж., Назарян А., Лян М. Г., Хью С. Ю., Шварцман А., Киран М. В., Клинические испытания ингибитора фарнезилтрансферазы у детей с синдромом Хатчинсона-Гилфорда прогерии, Труды Национальной академии наук, 9 октября 2012 г. 109 нет. 41 16666-16671
Октябрь 2011: новый подход к терапии прогерии
Этот аберрантный сплайсинг в культивируемых клетках кожи прогерии можно предотвратить таким образом, как было показано в 2005 г. (2). Однако для лечения пациентов ингибирующий реагент должен быть доставлен в неповрежденном виде во все ткани пациента. На разработку этих методов «доставки» потребовалось еще шесть лет и работа в нескольких лабораториях.
В новом исследовании (1) блокирование аберрантного сплайсинга у модельной мыши привело к впечатляющим результатам. Наблюдалось явное снижение концентрации прогерина во всех проанализированных тканях, кроме скелетных мышц, которые могут иметь пониженное поглощение блокирующего агента. Модельные мыши воспроизводили многие фенотипы пациентов с прогерией, включая
- Значительно сокращенная продолжительность жизни (дни 103 по сравнению с годами 2 для мышей дикого типа.)
- Снижение темпа роста.
- Нарушение осанки с искривлением позвоночника.
- Глубокие ядерные аберрации в результате накопления прогерина.
- Общая потеря жирового слоя под кожей.
- Глубокие изменения кости.
- Сердечно-сосудистые изменения, в том числе значительная потеря клеток гладких мышц сосудов.
- Изменения концентрации различных гормонов в плазме циркулирующей крови, в том числе инсулина и гормона роста.
Ассоциация в естественных условиях демонстрация эффективности снижения выработки прогерина путем блокирования аберрантного сплайсинга является убедительным кандидатом на новый ценный подход к терапии прогерией.
(1) Осорио Ф.Г., Наварро К.Л., Кадиньянос Дж., Лопес-Мехия И.С., Кирос П.М. и др., Наука трансляционной медицины, 3: Выпуск 106, предварительная онлайн-публикация, 26 октября (2011).
(2) Скаффиди П. и Мистели Т. Обращение клеточного фенотипа при болезни преждевременного старения Синдром прогерии Хатчинсона-Гилфорда, Nature Medicine 11 (4): 440-445 (2005).
Июнь 2011: исследование, финансируемое PRF, идентифицирует рапамицин как возможное лечение прогерии
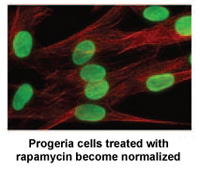
Исследователи из Национального института здравоохранения и Массачусетской больницы общего профиля в Бостоне, штат Массачусетс, опубликовали новое исследование сегодня в Наука, трансляционная медицина это может привести к новому лекарственному лечению детей с прогерией. *
Рапамицин является одобренным FDA лекарством, которое, как было показано ранее, продлевает жизнь мышам, не страдающим прогерией. Это новое исследование демонстрирует, что рапамицин уменьшает количество вызывающего заболевание белка прогерина на 50%, улучшает аномальную форму ядра и продлевает срок жизни клеток прогерии. Это исследование предоставляет первые доказательства того, что рапамицин может снижать пагубное действие прогерина на детей с прогерией.
Об этом очень много говорят в СМИ! Нажмите ниже для ссылок на статьи в СМИ:
Исследовательский фонд Progeria был рад предоставить ячейки для этого проекта от PRF Банк клеток и тканейи помочь финансировать исследования через наш программа грантов.
Это захватывающее новое исследование демонстрирует замечательные темпы исследований прогерии, обеспечивая при этом дополнительное понимание процесса старения, который затрагивает всех нас.
* «Рапамицин меняет клеточные фенотипы и повышает клиренс мутантного белка в клетках прогерии Хатчинсона-Гилфорда»
Кан Цао, Джон Дж. Грациотто, Сесилия Д. Блэр, Джозеф Р. Мадзулли, Майкл Р. Эрдос, Дмитрий Крейнк, Фрэнсис С. Коллинз
Sci Transl Med. 2011 Jun 29; 3 (89): 89ra58.
Июнь 2011: новаторское исследование по проблеме старения от прогерии
CBS Evening News, Wall Street Journal и Другое Отчет о новом исследовании
Исследователи Национального института здоровья обнаружили ранее неизвестную связь между прогерией и старением. Полученные данные позволяют понять взаимосвязь между токсичным белком, вызывающим прогерию, известным как progerin и теломеры, которые защищают концы ДНК внутри клеток, пока они не изнашиваются со временем и клетки не умирают.
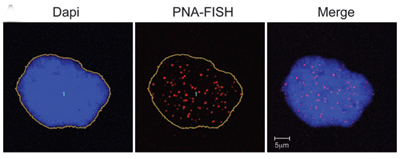
Экспрессирующие прогерин клетки от нормальных людей показывают признаки старения. ДНК в ядре окрашена в синий цвет. Теломеры видны как красные точки.
Исследование * опубликовано в июньском раннем онлайн-издании 13, 2011, журнала клинических исследований. Делается вывод, что при нормальном старении короткие или дисфункциональные теломеры стимулируют клетки продуцировать прогерин, что связано с возрастным повреждением клеток.
Впервые мы знаем, что укорочение и дисфункция теломер влияет на выработку прогерина », - говорит медицинский директор Фонда исследований Progeria Лесли Гордон, доктор медицинских наук. «Таким образом, эти два процесса, оба из которых влияют на старение клеток, на самом деле связаны».
Предыдущие исследования показали, что прогерин вырабатывается не только у детей с прогерией, но и в меньших количествах у всех нас, а уровень прогерина увеличивается с возрастом. Независимо от этого, предыдущие исследования по укорочению и дисфункции теломер были связаны с нормальным старением. Начиная с 2003, с открытием мутации гена Progeria и белка прогерина, который вызывает заболевание, одна из ключевых областей исследований была сосредоточена на понимании того, как и как связаны прогерия и старение.
«Связь этого феномена редких заболеваний и нормального старения приносит важные плоды», - сказал директор NIH Фрэнсис С. Коллинз, доктор медицинских наук, старший автор статьи. «Это исследование подчеркивает, что ценные биологические знания можно получить, изучая редкие генетические нарушения, такие как прогерия. С самого начала мы понимали, что у Progeria есть чему поучить нормальный процесс старения. «
Ученые традиционно изучали теломеры и прогерин отдельно. Хотя еще многое предстоит узнать о том, может ли это новое соединение привести к излечению детей с прогерией или может быть применено для увеличения продолжительности жизни человека, это исследование предоставляет дополнительные доказательства того, что прогерин, токсичный белок, обнаружен путем обнаружения мутации гена в прогерии. играет роль в нормальном процессе старения.
*Дисфункция прогерина и теломер взаимодействует, вызывая клеточное старение в нормальных фибробластах человекаCao et al. J Clin Invest DOI: 10.1172 / JCI43578.
Открыть для полного текста пресс-релиза NIH.
Май 2011: Обнаружена причина возникновения синдрома прогероида, что позволяет лучше понять связь Прогерии с возрастом
Исследовательская группа во главе с исследователем Progeria Доктор Карлос Лопес-Отин Из университета Овьедо в Испании встретились две семьи, у детей которых ранее была неизвестна болезнь ускоренного старения, похожая на прогерию. У детей не было дефектов в генах, которые ранее были связаны с прогероидными заболеваниями, но, изучая «кодирующие» части их геномов, команда обнаружила дефект в гене под названием BANF1. Члены семьи с прогероидной болезнью имели очень низкие количества белка, вырабатываемого BANF1, и, как и у людей с прогерией, ядерные оболочки в их клетках были заметно ненормальными. Аномалии исчезли в экспериментах на клеточных культурах, когда дефектный ген был заменен на правильную версию. Результаты были опубликованы в Американский журнал генетики человека Май 2011.
BANF1 теперь присоединяется к группе известных генов, которые, по-видимому, влияют на некоторые формы преждевременного старения, а также могут влиять на нормальное старение.
В последние несколько лет ученые смогли лучше понять нормальное старение на молекулярном уровне, отчасти благодаря исследованиям синдромов преждевременного старения, таких как этот, а также прогерии, которые «вызывают раннее развитие характеристик, обычно ассоциируемых с пожилым возрастом, ”Сказал Лопес-Отин. Он добавил, что его исследование «подчеркивает важность ядерной пластинки для старения человека и демонстрирует полезность новых методов секвенирования генома для выявления генетической причины редких и разрушительных заболеваний, которым традиционно уделяется ограниченное внимание».
Ксозе С. Пуэнте, Виктор Кесада, Фернандо Дж. Осорио, Рубен Кабанильяс, Хуан Кадиньанос, Джулия М. Фрайле, Гонсало Р. Ордоньес, Диана А. Пуэнте, Ана Гутьеррес-Фернандес, Мириам Фанхул-Фернандес и др. «Последовательность Exome и функциональный анализ идентифицируют мутацию BANF1 как причину наследственного прогероидного синдрома». Американский журнал генетики человека, май 5, 2011 DOI: 10.1016 / j.ajhg.2011.04.010
Август 2010: инсулиноподобный фактор роста 1 улучшает симптомы, продлевает жизнь прогероидной мыши
В августе 26, 2010, Артериосклероз, тромбоз и сосудистая биология перед публикацией в электронном виде опубликованы результаты исследования, сравнивающего прогерию и типичное сердечно-сосудистое старение, под названием «Сердечно-сосудистая патология при прогерисии Хатчинсона-Гилфорда: корреляция с сосудистой патологией старения». Исследование показало, что прогерин, аномальный белок, который вызывает прогерию, также присутствует в сосудистой сети населения в целом и увеличивается с возрастом, добавляя к растущему случаю, что есть параллели между нормальным старением и старением прогерии.
Исследователи изучили сердечно-сосудистые аутопсии и распределение прогеринов у пациентов с прогерией вместе с группой без прогерии в возрасте от одного месяца до 97 и обнаружили, что прогерин у лиц без прогерии увеличивался в среднем на 3.3 процентов в год в коронарных артериях.
«Мы обнаружили сходство между многими аспектами сердечно-сосудистых заболеваний как в прогерии, так и в атеросклерозе, которым страдают миллионы людей во всем мире», - сказал доктор Лесли Гордон, старший автор исследования и медицинский директор Фонда исследований Progeria. «Исследуя одну из самых редких болезней в мире, мы получаем критическое представление о болезни, которая поражает миллионы людей во всем мире. Текущие исследования могут оказать существенное влияние на наше понимание болезней сердца и старения ».
Это исследование подтверждает возможность того, что прогерин является фактором риска развития атеросклероза среди населения в целом, и заслуживает изучения как потенциальной новой черты, помогающей предсказать риск сердечных заболеваний.
Олив М, Хартен I, Митчелл Р, Бирс Дж, Джабали К, Цао К, Эрдос М.Р., Блэр С, Функе Б, Смут Л, Герхард-Херман М, Махан Дж. Т., Кутис Р, Вирмани Р, Коллинз Ф.С., Уайт Т.Н., Набель Э.Г., Гордон Л.Б.
«Сердечно-сосудистая патология при прогерсии Хатчинсона-Гилфорда: корреляция с сосудистой патологией старения». Arterioscler Thromb Vasc Biol. 2010 Ноябрь; 30 (11): 2301-9; Epub 2010 Авг 26.
Май 2010: Оксфордские исследования показывают, как исследования Прогерии могут помочь нам понять нормальное старение
Эта ситуация очень похожа на таковую в Прогерии. Там преламин А (называемый прогерином) сохраняет фарнезильную группу. Действительно, первым шагом к возникновению заболевания является неспособность удалить фарнезильную группу. Этот сбой происходит потому, что мутация прогерии приводит к удалению части преламина А, необходимой для FACE 1, чтобы связывать и удалять фарнезильную группу. Таким образом, причина дефектов старения и прогерии одна: FACE1 не может выполнять свою работу.
Уже несколько лет известно, что ингибиторы фарнезилтрансферазы (ИФТ) ингибируют (и могут обращать вспять) присутствие ядерных маркеров болезни в клетках прогерии. Shanahan et al. Обнаружили, что FTI ингибируют появление подобных ядерных маркеров в клетках пожилых нормальных людей. FTI в настоящее время используются в клинических испытаниях Progeria, и Шанахан и др. Отмечают, что эти клинические испытания «прольют дополнительный свет на терапевтический потенциал этих лекарств в лечении старения».
Исследования, описанные в этой статье, являются лучшим примером на сегодняшний день того, как исследования прогерии способствуют нашему пониманию нормального старения.
Ragnauth CD, Warren DT, Liu Y, Shanahan CM и др., «Преламин A ускоряет старение гладкомышечных клеток и является новым биомаркером старения сосудов человека». Тираж: 25 мая 2010 г., с. 2200-2210.
Апрель 2010: еще одно доказательство того, что в прогерии присутствие фарнезильной группы в молекуле прогерина отвечает за симптомы заболевания.
Дэвис и его коллеги подготовили новую модель мыши, у которой преламин А, в отличие от преламина РД, не фарнезилирован, но сохраняет аминокислотную последовательность 15, которая обычно расщепляется на пути синтеза ламина А. Эта мышь не имеет прогероидных симптомов, что указывает на что при RD, так же как и в Progeria, присутствие фарнезильной группы, а не изменение аминокислотной последовательности, является причиной симптомов заболевания.
DaviesBS, Barnes RH 2nd, Tu Y, Ren S, Andres DA, Spielmann HP, Lammerding J, Wang Y, Young SG, Fong LG,
«Накопление нефарнезилированного преламина А вызывает кардиомиопатию, но не прогерию», Hum Mol Genet. 2010 апр. 26. [Epub впереди печати]
Февраль 2010: больше доказательств, что FTIs оказывают благоприятное воздействие за счет фарнезилирования прогерина
Авторы оценили возможность того, что уменьшение прогероидного заболевания ингибитором фарнезилтрансферазы (FTI) в мышиной модели прогерии связано с влиянием препарата на фарнезилирование белка (белков), отличного от прогерина. Они сконструировали мышь, которая вырабатывала некарнезилированный прогерин, но не фарнезилированный прогерин. У этой мыши также развились фенотипические заболевания, похожие на прогерию, но FTI не улучшил их. Этот результат указывает на то, что лекарство не действует, ингибируя другие белки, кроме прогерина; он должен воздействовать на фарнезилирование прогерина, биохимический этап, которого нет в тестируемой модели.
Ян Ш.Г., Чанг С.Ю., Андрес Д.А., Шпильманн Л.П., Янг С.Г., Фонг Л.Г. «Оценка эффективности ингибиторов протеин фарнезилтрансферазы в мышиных моделях прогерии».
J Lipid Res. 2010 февраль; 51 (2): 400-5. Epub 2009 Октябрь 26.
Октябрь 2009: Искусство встречает науки в истории Бенджамина Баттона
Maloney WJ, «Синдром Хатчинсона-Гилфорда Прогерии: его представление в рассказе Ф. Скотта Фицджеральда« Загадочный случай Бенджамина Баттона »и его устные проявления».
Дж. Дент. Res 2009 Oct 88 (10): 873-6
Май 2009: Статья открывает новые возможности для влияния HGPS на клеточные функции.
Ранее было показано, что HGPS влияет на многие фундаментальные клеточные функции, включая репликацию, экспрессию генов и репарацию ДНК. Буш и его коллеги добавили транспорт белков из цитоплазмы в ядро к этому списку. Все белки синтезируются в цитоплазме, и те, которые попадают в ядро, должны проникать через ядерную мембрану. Транспортировка осуществляется через каналы в ядерной мембране, называемые «ядерные поры». Многие белки слишком велики, чтобы просто диффундировать через ядерные поры, но «пропускаются» через них специальными белками, которые эволюционировали для этой цели. В этой статье было обнаружено, что клетки, которые экспрессируют мутантный ген, ответственный за HGPS, имеют прямой транспорт белков в ядра путем прямого измерения.
Буш А., Киль Т., Хейпель В. М., Венер М., Хюбнер С. «Уменьшается импорт ядерного белка в клетках, экспрессирующих мутанты ламина А, вызывающие ядерную энтерпатию». Exp Res Cell. 2009 мая 11.
Апрель 2009: связь прогерии и нормального старения: новые идеи
→ Обеспечение структуры и организации: ядерная архитектура и целостность генома
→ Ущерб и ремонт ДНК пошли не так, как надо
→ Старые и не подлежащие восстановлению опухолевые супрессоры и клеточное старение, и
→ Регенерация и обновление: биология стволовых клеток. Регенерация и обновление: биология стволовых клеток.
В статье освещаются способы, которыми последние достижения в изучении прогероидных заболеваний дают представление об основных клеточных функциях, а также о старении.
Капелл Б.С., Тлоуган Б.Е., Орлоу С.Дж. «От самого редкого к наиболее распространенному: понимание прогероидных синдромов при раке кожи и старении». Журнал Следственного дерматологии (2009 апр. 23), 1-11
Апрель 2009: грантополучатели исследования PRF в прошлом разрабатывали новый метод изучения прогерина в клетках
Предыдущие эксперименты с клетками фибробластов от пациентов с прогерией показали, что повреждение, вызванное мутацией, первоначально является результатом действия измененной формы ламина А, называемой прогерин. Но интерпретация этих экспериментов может быть сложной в культуре для разных поколений. Фонг и др. и др. создали экспериментальную систему, в которой количество прогерина в Дикий тип клетки могут быть увеличены или уменьшены. Этот метод позволит исследователям отделить прямые эффекты прогерина от вторичных, тем самым продвигая изучение клеточных механизмов, которые приводят к патофизиологии клеток прогерии.
Активирует синтез прогерина, мутанта преламина А при прогериозном синдроме Хатчинсона-Гилфорда, с антисмысловыми олигонуклеотидами. (Статья PubMed) Фонг Л.Г., Виккерс Т.А., Фарбер Э.А., Чой С, Юнь У.Дж., Ху Й, Ян Ш., Кофиньер С., Ли Р., Инь Л., Дэвис Б.С., Андрес Д.А., Спилманн Л.П., Беннетт К.Ф., Янг С.Г., «Активация синтеза прогерин, мутантный преламин А при прогериозном синдроме Хатчинсона-Гилфорда, с антисмысловыми олигонуклеотидами ». Hum Mol Genet. 2009 Apr 17.
Д-ра. Фонг и Янг ранее финансировались за счет грантов Фонда исследований Progeria.
Январь 2009: Количественная оценка экспрессии гена прогерии в нормальных клетках и клетках прогерии с помощью новой, мощной техники.
Шведская команда обнаруживает накопление прогерин РНК в нормальных клетках с возрастом
Прогерин - аномальный белок, вызывающий прогерию. В последние годы несколько исследовательских групп обнаружили, что нормальные клетки также продуцируют прогерин, но намного меньше, чем клетки ребенка с прогерией. Кроме того, количество белка прогерина в нормальных клетках увеличивается с возрастом в лаборатории. Эти результаты установили прямую связь на клеточном уровне между прогерией и нормальным старением.
Доктор Мария Эрикссон, автор поиска генов для Progeria в 2003, теперь изобрела новый, мощный метод количественного измерения экспрессии гена Progeria. Лаборатория доктора Эрикссона в Каролинском институте в Швеции использовала методику для измерения количества прогерин РНК как в нормальных клетках, так и в клетках прогерии. РНК - это молекула проекта в наших клетках для производства белка. Шведская группа обнаружила, что как нормальные клетки, так и клетки прогерии вырабатывают все большее и большее количество прогерин РНК с возрастом. Результат Эрикссона показывает, что сигнал РНК для выработки прогерина быстро накапливается в клетках детей с прогерией и медленно накапливается в течение всей жизни у всех нас.
Эти новые результаты укрепляют наше понимание связи между нормальным старением и прогерией. Кроме того, ожидается, что новая методика будет широко использоваться в экспериментах, направленных на механизм действия прогерина.
Родригес С., Копеде Ф., Сагелиус Н. и Эриксон М. «Повышенная экспрессия транскрипта ламина А синдрома Хатчинсона-Гилфорда с прогерией при старении клеток». Европейский журнал генетики человека (2009), 1-10.
Август и октябрь 2008: обратима ли прогерия? Две недавние публикации показывают, что FTI и генная терапия могут сделать именно это!
Два отдельных исследования показывают, что прогерия обратима в сердечно-сосудистой системе и на коже мышей. Эксперименты были значительными, поскольку мышей не лечили до тех пор, пока у них не проявились симптомы прогерии, тогда как в большинстве предыдущих исследований лечение начиналось до того, как прогерия стала очевидной. Производство прогерина (повреждающего белка, полученного из гена прогерии) подавлялось либо обработкой ингибитором фарнезилтрансферазы (FTI), либо отключением гена. В обоих случаях мыши вернулись к нормальным или почти нормальным условиям. Эти наблюдения предоставляют обнадеживающие доказательства для текущего клинического исследования ИПП для лечения прогерии.
В ошеломляющей демонстрации прогресса с препаратом FTI - теперь используется в Первое в истории клиническое испытание препарата Progeria - Исследовательская группа доктора Фрэнсиса Коллинза из Национального института здоровья * обнаружила, что FTI предотвратила и даже обратила вспять самый разрушительный эффект прогерии у мышей: сердечно-сосудистые заболевания. * «Мы были поражены тем, что [препарат] так хорошо действует», - говорит Фрэнсис Коллинз, генетик и бывший директор Национального исследовательского института генома человека, который был старшим автором исследовательской группы, которая в 2003 году идентифицировала мутацию гена прогерии. у мышей, которые уже болели ".
У мышей Progeria развивается болезнь сердца, которая отражает болезнь у детей с прогерией. Авторы обнаружили, что FTI был способен в некоторой степени предотвращать развитие сердечных заболеваний, когда мышей лечили с момента отъема, и частично обращал вспять установленное заболевание, когда мышей лечили, начиная с возраста 9 месяцев. «Одной из поразительных вещей с моей точки зрения была способность обратить болезнь», - сказал Коллинз, что очень важно, учитывая, что прогерия обычно не диагностируется при рождении, а только тогда, когда у детей начинают проявляться симптомы, когда часть ущерба уже была сделанный.
«Если будет обнаружено, что эти препараты имеют сходные эффекты у детей, это может стать серьезным прорывом в лечении этого разрушительного заболевания», - сказал доктор Нэйбл, доктор медицинских наук, соавтор исследования. «Кроме того, эти данные проливают свет на потенциальную роль лекарств от ИППП для лечения других форм ишемической болезни сердца».
Посмотреть статью в Scientific American«Новая надежда на прогерию: лекарство от редкой болезни старения», в https://www.sciam.com/article.cfm?id=new-hope-for-progeria-drug-for-rare-aging-disease и пресс-релиз NIH в https://www.nih.gov/news/health/oct2008/nhgri-06.htm
* Capell, et. аль, «Ингибитор фарнезилтрансферазы предотвращает как начало, так и позднее развитие сердечно-сосудистых заболеваний на модели мышей Progeria». Труды Национальной академии наук, Том 105, нет 41, 15902-15907 (октябрь 14, 2008)
Во втором исследовании, опубликованном в Интернете в «Журнале медицинской генетики» **, исследовательская группа доктора Марии Эрикссон из Каролинского института в Швеции создала еще одну мышиную модель прогерии с аномалиями кожи и зубов. Мыши созданы с помощью генной инженерии, поэтому мутацию прогерии можно отключить в любой момент. Как только болезнь стала очевидной, ген прогерии был отключен. Через 13 недель кожа стала почти неотличимой от нормальной кожи. Это исследование показывает, что в этих тканях экспрессия мутации прогерии не вызывает необратимых повреждений и что возможно обращение болезни вспять, что дает надежду на лечение прогерии.
** Эрикссон, эт. al., «Обратимый фенотип на мышиной модели синдрома Хатчинсона-Гилфорда Прогерии». J. Med. Жене. опубликовано в сети 15 Авг 2008; DOI: 10.1136 / jmg.2008.060772
Чтобы приобрести эту статью, перейдите по ссылке: https://jmg.bmj.com/cgi/rapidpdf/jmg.2008.060772v1
Больше доказательств связи между прогерией и нормальным старением и сердечными заболеваниями
Эти захватывающие исследования Капелла и Эрикссона показывают, что помимо прогерии эти результаты могут принести пользу всем пациентам с сердечно-сосудистыми заболеваниями. Исследователи обнаружили, что токсический белок, ответственный за прогерию, на самом деле вырабатывается у всех людей на низком уровне, возможно, накапливаясь с возрастом. Таким образом, изучая этих редких детей, мы можем углубить наше понимание основного механизма старения человека и, возможно, найти новые способы замедления процесса.

